 |

Ананько Е.А.,
Игнатьева Е.В.,
Недосекина Е.А.,
Суслов В.В.,
Подколодная О.А.,
Ратушный А.В.,
Степаненко И.Л.,
Колчанов Н.А.
Институт цитологии и генетики СО РАН
Ключевые слова: регуляция транскрипции, генные сети (ГС), базы данных (БД).
Введение: Обширность и разнородность накопленных экспериментальных молекулярно-биологических данных по регуляции экспрессии генов порождает проблему их компьютерного анализа и систематизации в рамках единого подхода. В этом может помочь представление об организме, как о функциональной иерархии генных сетей, контролирующих все происходящие в организме процессы. Генная сеть (ГС) - это группа координировано экспрессирующихся генов, контролирующих выполнение определенной функции организма. В докладе дается попытка классификации ГС на основе информации, накопленной в базе данных (БД) GeneNet, созданной в ИЦиГ СО РАН в Лаборатории теоретической генетики.
Анализ информации из БД GeneNet, а также из имеющихся литературных данных позволяет выделить четыре основных типа ГС: ГС необратимых процессов, например, процессов роста и дифференцировки клеток, морфогенеза тканей и органов, роста и развития организмов (i), ГС циклических процессов, например, клеточного цикла, цикла сокращения сердечной мышцы и т.д. (ii), ГС гомеостаза биохимических и физиологических параметров организма (iii) и ГС реакций организмов на средовые изменения, например, стрессовый ответ (iiii). Рассмотрим некоторые особенности организации ГС.
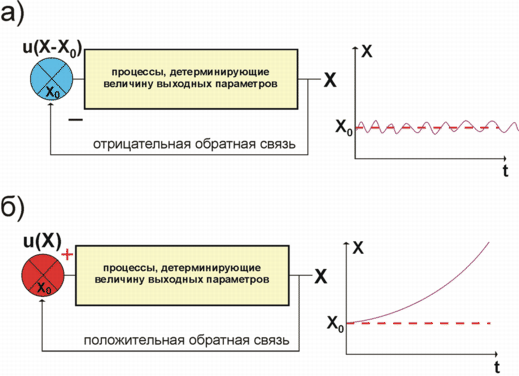
Характерная черта ГС, контролирующих дифференцировку клеток, морфогенез тканей и органов, рост и развитие организмов - множество регуляторных контуров с положительными обратными связями. Эти контуры обеспечивают максимально эффективное отклонение контролируемого параметра Х от его текущего значения (рис. 1б).
 |
Наример, в ГС дифференцировки и созревания эритроцитов, основным внешним регулятором является эритропоэтин. После его связывания с мембранным рецептором [4] включается путь передачи сигнала, осуществляемый клеточными протеинкиназами. В результате происходит фосфорилирование, перемещение в ядро и ацетилирование ряда транскрипционных факторов [1, 12]. Они активируют транскрипцию ряда генов, в том числе гена, кодирующего транскрипционный фактор GATA-1 (рис. 2) [3]. Наличие сайтов связывания фактора GATA-1 в промоторе собственного гена приводит к быстрому автоусилению его транскрипции по механизму положительной обратной связи [9]. Эта положительная обратная связь является очень эффективной и быстродействующей, т.к. в ее функционирование не вовлечены другие гены-посредники. Сайт связывания фактора GATA-1 присутствует также в промоторе гена, кодирующего рецептор эритропоэтина (EPOR) [2]. В результате активации транскрипции этого гена увеличивается количество молекул эритропоэтинового рецептора на клеточной мембране, повышается интенсивность прохождения сигнала от эритропоэтина через его рецептор к гену GATA-1. Тем самым замыкается еще один контур положительной обратной связи, обеспечивающий дополнительное автоусиление транскрипции гена GATA-1 (рис.2).
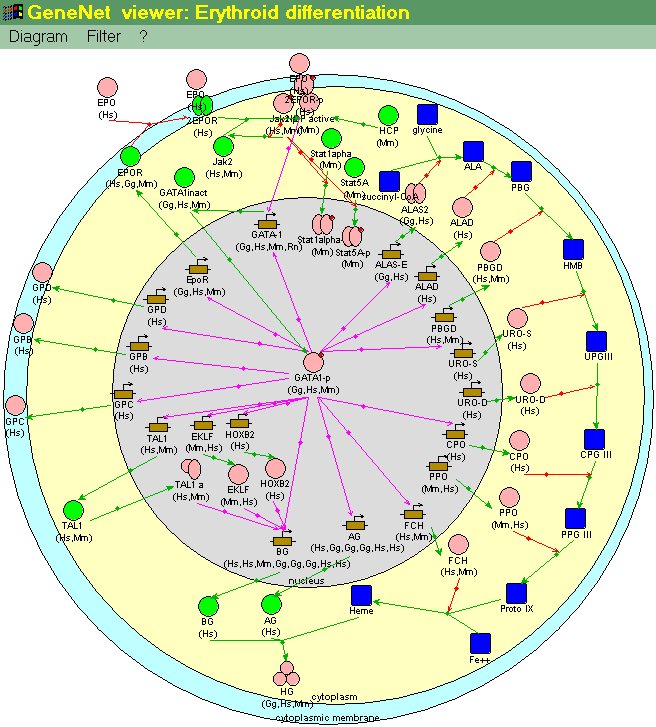 |
Фактор GATA-1 - ключевой регулятор созревания и дифференцировки эритроцитов. Сайты его связывания обнаружены в регуляторных районах практически всех эритроид-специфичных генов, в частности, генов, кодирующих альфа- и бета-субъединицы гемоглобина, ферменты биосинтеза гема и других. Благодаря этому под действием GATA-1 осуществляется одновременная стимуляция транскрипции всех этих генов, в том числе генов, кодирующих эритроид-специфичные транскрипционные факторы HOXB2, TAL1, EKLF, RBTN2. [6, 10]. Эти факторы обеспечивают дополнительную стимуляцию эритроид-специфичных генов. Таким образом, происходит включение каскада процессов, обеспечивающих терминальную дифференцировку и созревание эритроцита (рис.2).
Каскадная активация генов, большое количество положительных регуляторных воздействий и наличие ключевых активаторов наблюдаются практически во всех ГС, запускающих необратимые процессы в организме. Например, в ГС, регулирующей прорастание семян, активация начинается с действия внешнего стимула (воды). Быстрое и необратимое развитие процесса достигается за счет положительной обратной связи (синтез гиббереллинов растущими клетками зародыша приводит к активации генов ферментов и усилению питания зародыша), и за счет кассетной активации генов [14].
Важную роль в работе таких ГС играет регуляция по механизму отрицательной
обратной связи, которая предназначена для поддержания величины
контролируемого параметра организма X вблизи оптимального уровня X![]() (рис. 1а). В качестве примера рассмотрим ГС, регулирующую концентрацию
холестерина в клетке (рис. 3). Синтез холестерина осуществляется при участии
ферментов мевалонатного пути [5]. Усиление транскрипции кодирующих их генов
приводит к повышению концентрации холестерина в клетке. Ключевые регуляторы
этого пути - транскрипционные факторы подсемейства SREBP (sterol regulatory
element-binding proteins), Они активируют транскрипцию генов, кодирующих
многие ферменты мевалонатного пути. SREBP образуется из неактивного
предшественника (preSREBP) под действием стерол-регулируемой протеазы (SRP)
[11]. Повышение уровня холестерина подавляет активность стерол-регулируемой
протеазы, замедляя переход preSREBP в активную форму. Тем самым снижается
уровень активного SREBP, транскрипционная активность генов мевалонатного
пути падает, синтез холестерина замедляется, и его уровень в клетке
нормализуется.
(рис. 1а). В качестве примера рассмотрим ГС, регулирующую концентрацию
холестерина в клетке (рис. 3). Синтез холестерина осуществляется при участии
ферментов мевалонатного пути [5]. Усиление транскрипции кодирующих их генов
приводит к повышению концентрации холестерина в клетке. Ключевые регуляторы
этого пути - транскрипционные факторы подсемейства SREBP (sterol regulatory
element-binding proteins), Они активируют транскрипцию генов, кодирующих
многие ферменты мевалонатного пути. SREBP образуется из неактивного
предшественника (preSREBP) под действием стерол-регулируемой протеазы (SRP)
[11]. Повышение уровня холестерина подавляет активность стерол-регулируемой
протеазы, замедляя переход preSREBP в активную форму. Тем самым снижается
уровень активного SREBP, транскрипционная активность генов мевалонатного
пути падает, синтез холестерина замедляется, и его уровень в клетке
нормализуется.
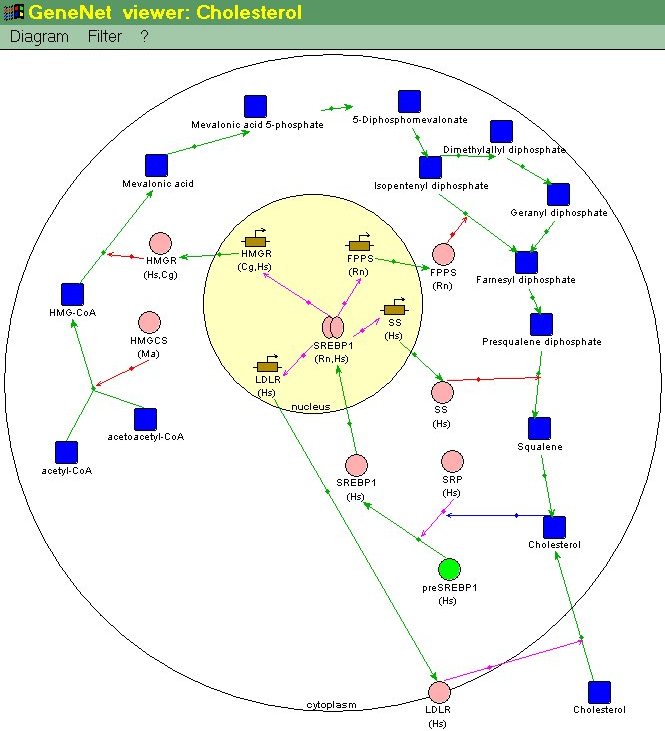 |
Важную роль в поддержании уровня холестерина в клетке играет интенсивность его транспорта через клеточную мембрану из межклеточного пространства, который осуществляется при участии рецептора липопротеина низкой плотности (LDLR). При сниженной концентрации холестерина повышается концентрация активного SREBP и происходит активация транскрипции гена, кодирующего LDLR [7]. При повышенном внутриклеточном уровне холестерина снижается активность стерол-регулируемых протеаз и, соответственно, концентрация активного SREBP. В свою очередь, это влечет за собой уменьшение транскрипционной активности гена LDLR и снижение транспорта холестерина внутрь клетки.
Характерной чертой рассмотренной ГС является ее активация при понижении уровня параметра, на который настроена сеть (концентрация холестерина) и блокирование активированных процессов при повышении уровня контролируемого параметра выше заданного. Подобные механизмы действуют практически во всех гомеостатических ГС, например, в ГС, контролирующих тиреоидную систему, и редокс-регуляцию, которые также описаны в БД GeneNet [14].
Для ГС, обеспечивающих ответ на изменения внешней среды характерен двухэтапный механизм действия. Первоначально происходит быстрая активация ГС за счет действия положительных регуляторных механизмов. На более поздних этапах начинается действие регуляторных контуров с отрицательными обратными связями, и система возвращается в начальное состояние.
В качестве примера рассмотрим ГС теплового шока (из-за сложности ГС теплового шока на рис. 4 приведен ее фрагмент, включающий основные регуляторные контуры - ГС саморегуляции HSP70). Механизмы ответа на тепловой шок консервативны в клетках всех организмов от бактерий до человека. Повышение температуры, как и другие стрессы (гипоксия, соли тяжелых металлов и т.д), активирует гены, кодирующие белки теплового шока (HSP), и подавляет синтез других белков. Белки теплового шока, как молекулярные шапероны, защищают другие белки от разрушения и клетку от гибели. Ключевой регулятор системы генов теплового шока - транскрипционный фактор HSF-1 (рис. 4). В нормальных условиях HSF-1 присутствует в цитоплазме в неактивной форме (в том числе и за счет связывания с регуляторными белками HSP70 и HSP90). При тепловом шоке белки клетки частично денатурируются. Молекулярные шапероны HSP70 и HSP90 связываются с гидрофобными участками таких поврежденных белков [13]. При этом HSF-1 освобождается, тримеризуется, фосфорилируется, проникает в ядро и активирует транскрипцию генов теплового шока, в том числе и гена hsp70, вытесняя с регуляторных районов этих генов репрессор CHBF. Избыток в цитоплазме клетки HSP70, не связанного с белками, приводит к его связыванию в ядре с HSF-1 (рис. 4), инактивации этого транскрипционного фактора и его обратному транспорту в цитоплазму [14]. Таким образом, происходит выключение ответа на воздействие стрессового фактора. Кроме того, при тепловом шоке подавляется синтез транскрипционного фактора Ku70, входящего в состав активаторного комплекса полимеразы I. Это приводит, в частности, к подавлению транскрипции 45S гена рибосомальной РНК и прекращению синтеза рибосомальных белков [14].
Отсутствие в этой ГС положительной обратной связи объясняется, тем, что в цитоплазме уже присутствует в необходимом количестве неактивный регуляторный фактор, который при стрессовом ответе просто переходит в активное состояние. При этом молекулярными сигналами, активирующими ГС теплового шока, являются денатурированные белки. Не исключено, однако, что при дальнейшем изучении этой ГС регуляторный контур с положительной обратной связью будет найден.
Тот же принцип заложен в основу работы ГС, контролирующей противовирусный ответ, которая также описана в БД GeneNet [14].
В гибридных ГС осуществляется координированная экспрессия генов нескольких различных организмов. В БД GeneNet в настоящее время описана ГС, контролирующая образование клубеньков (nodulation) и азотфиксацию у бобовых, ядро которой составляют гены как растения, так и азотфиксирующей бактерии. Эта ГС, управляя генами двух различных организмов (бактерии и растения-хозяина), контролирует процесс собственного формирования (дифференцировку и пролиферацию клеток растений, проникновение бактерий в растительную клетку). Сформировавшись, ГС по механизму отрицательной обратной связи управляет процессом азотфиксации.
Флавоноиды, секретируемые корнями растений, индуцируют транскрипцию nodD гена азотфиксирующих бактерий (Rhizobium, Bradyrhizobium и Azorhizobium). NodD белок активирует транскрипцию других бактериальных nod-генов, участвующих в образовании сигнальной молекулы - липоолигосахарида Nod-фактора. Этот фактор стимулирует дифференцировку эпидермальных клеток растений, индуцирует экспрессию ранних генов нодулинов [37] и генов клеточного цикла растений. В результате образуется сложная структура - азотфиксирующий клубенек. Бактерии попадают в цитоплазму примордиальных клеток клубенька в результате эндоцитоза. После этого примордиум клубенька дифференцируется в зрелый клубенек. В его клетках начинается экспрессия поздних генов нодулинов растений. Продукты этих генов вместе с продуктами бактериальных генов nif и fix включают азотфиксацию. Избыток аммония, конечного продукта азотфиксации, ингибирует активность nod генов бактерий, что приводит к уменьшению фиксации азота (рис. 5) [14].
Сложнейшие механизмы регуляции экспрессии генов эукариот обеспечивают получение необходимых количеств генных продуктов в определенных клетках, тканях и органах в определенные моменты жизни. Экспрессия любого гена регулируется в рамках ГС при тесном взаимодействии всех элементов сети. При этом следует учитывать иерархический принцип функционирования многоклеточного организма. Низшим уровнем является уровень клетки. Объединения клеток образуют ткани и органы. Высшим уровнем является организм в целом.
ГС, управляющие жизнедеятельностью организма, также организованы по иерархическому принципу. На рис.6 схематически представлена иерархия локальных ГС, обеспечивающих выполнение различных функций в организмах. Самый низкий уровень иерархии соответствует ГС базального метаболизма клетки. Их функция зависит от стадии клеточного цикла и может быть подавлена или активирована в зависимости от регуляторных воздействий, поступающих от ГС вышележащих уровней. Эти воздействия могут изменять интенсивность и направленность как метаболических процессов, так и процессов клеточного деления. Наиболее высокие уровни организации соответствуют ГС рецепции сигналов окружающей среды и ГС, обеспечивающим ментальные функции.
При всей условности представленной классификации, она подчеркивает существование групп ГС, выполняющих качественно сходные функции, их взаимодействие и соподчинение. В глобальной и иерархически организованной ГС целого организма управляющие сигналы идут не только от более высоких уровней к более низким, но и в обратном направлении. При этом сигналы могут иметь как положительный (активирующий), так и отрицательный (подавляющий) характер.
Анализ информации, собранной в GeneNet, позволяет выявить некоторые принципы организации ГС:
 Ваши комментарии
Ваши комментарии
|
![[SBRAS]](/gif/s_sigma.gif)
[Головная страница] [Конференции] [СО РАН] |
© 2001, Сибирское отделение Российской академии наук, Новосибирск
© 2001, Объединенный институт информатики СО РАН, Новосибирск
© 2001, Институт вычислительных технологий СО РАН, Новосибирск
© 2001, Институт систем информатики СО РАН, Новосибирск
© 2001, Институт математики СО РАН, Новосибирск
© 2001, Институт цитологии и генетики СО РАН, Новосибирск
© 2001, Институт вычислительной математики и математической геофизики СО РАН, Новосибирск
© 2001, Новосибирский государственный университет
Дата последней модификации Tuesday, 25-Sep-2001 11:03:35 NOVST