Методом химической поляризации ядер (ХПЯ) изучена динамика внутримолекулярного движения ароматических радикалов аминокислот в молекуле белков α-лактальбумина (см. рисунок 1). Моделированием экспериментальных кинетик ХПЯ определены времена ядерной парамагнитной релаксации протонов этого белка. В сравнении со свободными аминокислотами установлено, что времена корреляции внутримолекулярных движений протонов поляризованных остатков обратно пропорциональны их доступности в белке. Проведено сравнение ХПЯ в нативных белках с ХПЯ в белках, имеющих различную степень денатурации (начиная с расплавленной глобулы). Показано, что определение значений времен релаксации в микросекундном временном диапазоне позволяет изучать степень нарушения нативной структуры белковых макромолекул. Предложенный метод, в отличие от других релаксометрических методов, открывает перспективу изучения внутримолекулярной подвижности остатков в белках в водных растворах в микросекундном диапазоне времен.
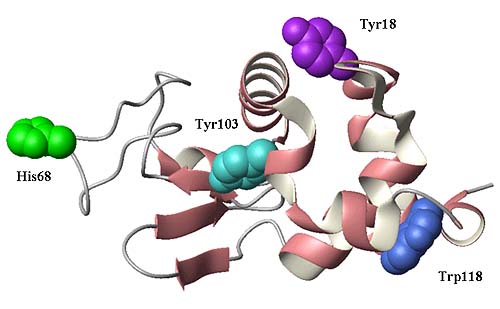 Рис. 1. Структура белка α-лактальбумина коровы в нативном состоянии с выделенными аминокислотными остатками, участвующими в формировании химической поляризации ядер (ХПЯ).
|


